Гидролиз солей — взаимодействие
ионов соли с водой, в результате которого образуются малодиссоциируемые
соединения (ионы или молекулы) и изменяется реакция среды.
Гидролизу подвергаются три типа солей:
- а) соли, образованные слабым основанием и сильной кислотой (CuCl2,
NH2Cl,
Fe2(S04)3
— гидролиз по катиону);
- б) соли, образованные сильным основанием и слабой кислотой (К2С03,
Na2S
— гидролиз по аниону);
- в) соли, образованные слабым основанием и слабой кислотой (NH4)2C03,
Fe2(C03)3
- гидролиз ng катиону и по аниону).
Соли, образованные сильным основанием и сильной кислотой, гидролизу не
подвергаются (NaCl, К2SО4,
Ba(N03)2).
В растворе NaCl индикаторы не изменяют свою окраску, т. к. растворенный
в воде хлорид натрия находится в виде ионов:
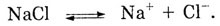
NaCl «=* Na+ + СГ. Вода, хоть и незначительно, но диссоциирует
на ионы, и устанавливается равновесие:
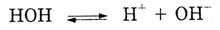
Таким образом, в растворе поваренной соли есть смесь катионов Na+
и анионов ОН-,
Сl-.
Ионы в растворе перемещаются беспорядочно и постоянно сталкиваются друг
с другом. Но эти столкновения ионов Na+
и ОН-
, ионов Н+
и Сl-
к образованию соединений не приводят, так как NaOH - сильное основание,
а НСl - сильная кислота. Так как слабые электролиты при растворении хлорида
натрия в воде не образуются, хлорид натрия гидролизу не подвергается.
Концентрация ионов Н+
равна концентрации ионов ОН-,
поэтому окраска индикаторов не изменяется.
Фенолфталеин становится малиновым в растворе соды Na2C03,
т. к. Na2CO3
хорошо растворяется в воде и диссоциирует:
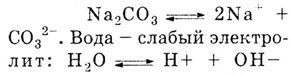
Столкновение ионов Na+
и ' C032-
образуется малодиссоциирующий гидрокарбонатион. Вследствие связывания
ионов Н+
в малодиссоциируюущий продукт, равновесие диссоциации воды смещается в
сторону накопления ионов ОН-.
Раствор приобретает щелочную реакцию:
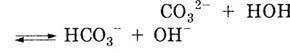
Под действием анионов ОН-
фенолфталеин становится малиновым.
Раствор хлорида алюминия имеет кислую среду, т. к. в растворе АlСl3
диссоциирует на ионы:
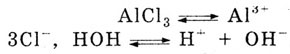
Столкновение ионов Н+
и Сl-
к образованию соединения не приводит. Из имеющихся в растворе ионов малодиссоциирующий
продукт образуют ионы Аl3+
и ОН-.
Связывание ионов ОН-
в малодиссоциирующий ион АlOН2+
вызывает смещение равновесия диссоциации воды в сторону накопления ионов
Н+.
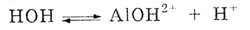
|
 При любом использовании материалов установите обратную ссылку на своем сайте.
При любом использовании материалов установите обратную ссылку на своем сайте.

 <a href="http://lovi5.ru/" target=_blank>Рефераты, шпаргалки</a>
<a href="http://lovi5.ru/" target=_blank>Рефераты, шпаргалки</a>