Экзотермические реакции —
это реакции, происходящие с выделением теплоты. Эндотермические реакции
— это реакции, происходящие с поглощением теплоты.
Тепловой эффект химической реакции - это количество выделенной или поглощенной
теплоты в результате химической реакции.
Энтальпия (Н) — это определенное свойство вещества, оно является мерой
энергии, накапливаемой веществом при его образовании. Доказано, что в
химических процессах, протекающих при постоянном давлении, выделившееся
(или поглощенное) тепло есть мера уменьшения (или, соответственно, увеличения)
энтальпии реакции,  Н. Н.
Таким образом, при экзотермических реакциях, когда тепло выделяется,
 Н отрицательно. При эндотермических
реакциях (тепло поглощается) Н отрицательно. При эндотермических
реакциях (тепло поглощается)  Н
положительно. Н
положительно.
В термохимических уравнениях реакций записывают значения  Н
- разность энтальпий продуктов реакции и исходных веществ. Н
- разность энтальпий продуктов реакции и исходных веществ.
Наряду с энтальпией используют равную по абсолютной величине и противоположную
по знаку величину, например:
Н2
+ Сl2
= 2НСl + Q,
где Q — количество выделенной теплоты. Если использовать энтальпию(характеристику
энергосодержания системы), то это уравнение следует записать иначе:
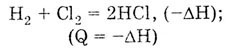
Теплотой образования соединения называется количество теплоты, которое
выделяется или поглощается при образовании одного моля химического соединения.из
простых веществ при стандартных условиях (Р = 101,3 Па, Т = 298К). Она
измеряется в кДж/ моль. Так, например, теплота образования одного моля
жидкой воды из 2 г (один моль) водорода и 16 г (0,5 моль) кислорода равна
285,8 кДж:
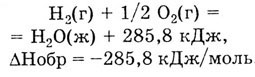
Теплотой разложения соединения называется
количество теплоты, которое выделяется или поглощается при разложении
одного моля вещества при стандартных условиях. Теплота разложения данного
соединения равна теплоте его образования, но имеет противоположный знак.
Так, при разложении 1 моль воды поглотится 285,8 кДж теплоты:
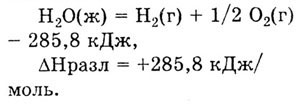
Теплотой сгорания соединения называется количество
теплоты, которое выделяется при сгорании одного моля вещества. Например,
теплота сгорания ацетилена равна 1300 кДж:
С2Н2(г)
+ 2 1/2 О2(г)
= Н2O(г)
+ 2С02(г)
+ 1300 кДж,
 Нсгор
= -1300 кДж/моль. Нсгор
= -1300 кДж/моль.
Закон Гесса (его называют также законом
суммы тепловых эффектов). Тепловой эффект химической реакции зависит от
состояния исходных веществ и продуктов реакции, но не зависит от промежуточных
стадий реакций. Следствие, вытекающее из закона Гесса: тепловой эффект
химической реакции равен разности суммы теплот образования продуктов реакции
и суммы ( теплот образования исходных ^веществ. Суммирование проводится
с учетом числа молей веществ, участвующих в реакции, т. е. стехиометрических
коэффициентов в уравнении протекающей реакции. Например:

|
 При любом использовании материалов установите обратную ссылку на своем сайте.
При любом использовании материалов установите обратную ссылку на своем сайте.

 <a href="http://lovi5.ru/" target=_blank>Рефераты, шпаргалки</a>
<a href="http://lovi5.ru/" target=_blank>Рефераты, шпаргалки</a>