|
МОЛЕКУЛЯРНАЯ ФИЗИКА
6. Первый закон термодинамики Работа и энергия в термодинамической системе. Термодинамическая система может разными способами обмениваться энергией с окружающей средой, поглощая или отдавая количество теплоты и совершая работу. Приняты следующие соглашения: количество теплоты, поступающее в систему, считается положительным ( Q > 0 ); если система отдает количество теплоты окружающей среде, то Q < 0 . Если система совершает работу, то эта работа принимается положительной ( А > 0 ); если работа совершается внешними источниками над системой , то A < 0 .Пусть система находится в каком-то термодинамическом состоянии, отвечающем точке 1 на pV-диаграмме. Возможны несколько разных путей (процессов), переводящих систему из состояния 1 в состояние 2 . Важно, что работа, совершаемая системой при переходе 1 (r) 2, зависит от пути, т.е. от конкретных деталей процесса (можно совершить переход изотермически, адиабатически, изобарически, изохорически или путем комбинации всех этих способов, при этом совершаемая работа будет разной . Точно так же будут разными количества теплоты, поступающие в систему или отдаваемые системой при таком переходе. Таким образом, ни работа A , ни количество теплоты Q не являются функциями состояния системы (если бы это было так, то A Q зависели бы только от начального и конечного состояний системы) . Однако многочисленные эксперименты показывают, что разность Q - A не зависит от характера протекания процесса и определяется только начальным и конечным состояниями системы. Так как эти состояния обладают определенной внутренней энергией U , которая для идеального газа зависит только от температуры, то на основании закона сохранения энергии, обобщенного на случай тепловых явлений, можно записать:
Первый закон (первое начало) термодинамики : В тепловом процессе, в котором количество теплоты Q поступает в систему и сама система совершает работу A , полная энергия, переданная системе, равна изменению внутренней энергии системы D U .На самом деле, первый закон термодинамики может быть сформулирован в более общем виде, если иметь в виду эквивалентность всех форм энергии: В любой изолированной системе полная внутренняя энергия неизменна, хотя может переходить из одной формы в другую . Если на pV -диаграмме отмечены две точки (два состояния) и с помощью любой комбинации тепловых процессов осуществлен переход из состояния 1 в состояние 2, то можно утверждать, что внутренняя энергия системы изменилась на величину U 2 - U 1 . Отсюда следует, что для любого замкнутого цикла, в результате которого система возвращается в исходное состояние, изменение внутренней энергии равно нулю. Но это не означает, что в замкнутом цикле не совершается работа или не поглощается (выделяется) количество теплоты. Выражая закон сохранения энергии, первый закон термодинамики остается справедливым для любых процессов указанных выше четырех общих типов. Иными словами, в формуле, выражающей содержание первого закона, знаки A Q могут быть разными в зависимости от характера процесса. Соответственно D U может быть как положительной, так и отрицательной величиной. Изохорический процесс. На каждом шаге квазистатического изохорического процесса объем не меняется, dV = 0 , следовательно, система не совершает работы: dA = pdV = 0 . Поэтому полная работа А также равна нулю и D U = Q . Молярная теплоемкость идеального газа при постоянном объеме определяется из соотношения d Q = n c V dT , где - число молей газа. Так как dU = d Q при постоянном объеме, то
Но U = (3/2) n RT для идеального одноатомного газа, поэтому молярная теплоемкость идеального одноатомного газа при постоянном объеме равна
Адиабатический процесс . В таком процессе система не обменивается количеством теплоты с окружающей средой (система теплоизолирована), и на каждом шаге d Q = 0 . Поэтому для всего процесса Q = 0 D U = - A . Изотермический процесс . В этом процессе температура не меняется, следовательно, не меняется и внутренняя энергия идеального газа: D U = 0 . Отсюда следует, что в изотермическом процессе вся совершаемая идеальным газом (следует учесть, что это очень частный случай) работа равна количеству теплоты, поступившей в систему: A = Q . Конечно, для реальных газов это утверждение неверно. Изобарический процесс. Так как давление постоянно, то работа в этом случае равна произведению постоянного давления на величину изменения объема: A = p(V 2 - V 1 ) . |
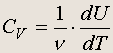
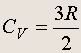 (6.1)
(6.1)
 При любом использовании материалов установите обратную ссылку на своем сайте.
При любом использовании материалов установите обратную ссылку на своем сайте.
