Химическое равновесие наступает при условии, когда скорости
прямой и обратной реакций равны. Например, если в реакции:
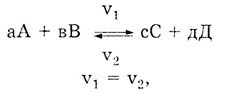
то система находится в состоянии химического равновесия.
Задача. Почему с увеличением концентрации
исходных веществ скорость реакции возрастает? Запишите эту зависимость
в общем виде в математической форме.
Решение. При увеличении концентрации реагирующих
веществ скорость реакции увеличивается потому, что растет число столкновений,
а следовательно, и вероятность химического превращения. Для реакции в
общем виде аА + вВ --> АаВв можно записать скорость реакции v = К[А]a
• [В]B,
где [А] и [В] - концентрации исходных веществ, моль/л; К — константа скорости
реакции. Если [А] = [В] = 1 моль/л, то К = v, то есть К - это скорость
реакции при условии, что концентрации исходных веществ равны одному молю
в литре.
Задача. Почему при повышении температуры
скорость реакции возрастает? Выразите эту зависимость математически.
Решение. Простейшая зависимость скорости
реакции от температуры выражается правилом Вант-Гоффа, согласно которому
при повышении температуры на каждые 10 градусов скорость большинства реакций
увеличивается в 2-4 раза:
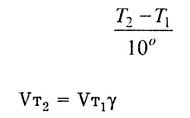
Повышение температуры приводит к увеличению скорости реакции, так как
при этом резко возрастает число активных молекул. За счет дополнительной
энергии, полученной системой извне, молекулы приобретают необходимый запас
энергии активации и, таким образом, становятся реакционноспособными.
|
 При любом использовании материалов установите обратную ссылку на своем сайте.
При любом использовании материалов установите обратную ссылку на своем сайте.

 <a href="http://lovi5.ru/" target=_blank>Рефераты, шпаргалки</a>
<a href="http://lovi5.ru/" target=_blank>Рефераты, шпаргалки</a>